Nature Genetics | 揭示肺纤维化新视界:从小鼠到人的空间转录组学描绘特发性肺纤维化(IPF)病理机制
来源:生物探索 2024-07-04 09:27
该研究通过空间转录组学和单细胞RNA测序技术,详细描绘了IPF和小鼠肺纤维化模型中的细胞相互作用和信号传导途径,揭示了关键的趋同和分歧路径。
特发性肺纤维化(Idiopathic Pulmonary Fibrosis,IPF)是一种慢性、进行性和不可逆的肺部疾病,其特征是肺组织逐渐被纤维化组织替代,导致肺功能下降和呼吸困难。尽管近年来在理解IPF病理生理机制方面取得了一些进展,但目前的治疗选择仍然非常有限,且多局限于延缓疾病进展,而无法治愈。IPF的发病机制复杂,涉及多种细胞类型和信号通路的异常变化,包括异常的基质沉积、慢性炎症反应以及肺泡上皮细胞的损伤和修复失调。
传统的动物模型,如博莱霉素(bleomycin)诱导的小鼠肺纤维化模型,虽然在一定程度上能够模拟人类IPF的病理特征,但由于物种间的差异,这些模型在药物筛选和机制研究中的转化应用受到限制。因此,开发更为精准的研究工具和方法,以揭示IPF的分子和细胞机制,对于推动新的治疗策略至关重要。
空间转录组学(spatial transcriptomics,SRT)是一种新兴的技术,能够在组织的空间背景下,分析和定位基因表达情况。这项技术允许研究人员在组织切片上识别不同细胞类型及其相互作用,从而提供比单细胞RNA测序(single-cell RNA sequencing,scRNA-seq)更全面的组织结构和功能信息。通过将SRT与scRNA-seq数据整合,研究人员可以更好地理解细胞在组织微环境中的分布和相互作用。
7月1日的Nature Genetics的报道“Mapping spatially resolved transcriptomes in human and mouse pulmonary fibrosis”在该研究中,作者利用SRT技术,生成了人类IPF患者和博莱霉素诱导的小鼠肺纤维化模型的空间转录组图谱。通过这些图谱,研究揭示了IPF肺中存在的不同纤维化生态位,并详细描述了这些生态位中细胞类型和信号通路的特征。研究发现,IPF纤维化生态位中的肺泡上皮细胞再生受阻,而在急性纤维化小鼠模型中,则表现为活跃的组织修复。这些发现为IPF的发病机制提供了新的见解,并提出了肺泡再生作为潜在治疗策略的前景。
此外,该研究还结合了单细胞RNA测序数据,揭示了与IPF相关的异常细胞状态和特定细胞群体的分布,包括新的KRT5−/KRT17+异常基底样(AbBa)上皮细胞群体。这些细胞群体的发现,进一步丰富了我们对IPF病理生理机制的理解,并为未来的研究和治疗策略提供了新的靶点和方向。通过深入分析IPF和小鼠纤维化模型中的细胞相互作用和信号传导途径,该研究为理解IPF提供了新的视角,并为未来的治疗干预提供了重要依据。

特发性肺纤维化(Idiopathic Pulmonary Fibrosis,IPF)是一种严重的进行性肺部疾病,特征是肺组织的纤维化,导致呼吸困难和肺功能衰竭。IPF 的病因尚不完全明确,目前的治疗方法有限且效果不佳。为了深入理解IPF的发病机制,该研究利用空间转录组学(Spatial Transcriptomics,SRT)技术和单细胞RNA测序(Single-cell RNA Sequencing,scRNA-seq)技术,绘制了人类和小鼠肺纤维化模型的基因表达图谱,从而揭示了纤维化生态位及其相关细胞类型和信号通路的特征。
研究使用了从IPF患者和健康对照(Healthy Controls,HCs)获取的肺组织样本,以及博莱霉素(Bleomycin,BLM)诱导的小鼠肺纤维化模型。通过对这些样本进行空间转录组学分析,研究团队构建了详细的基因表达图谱,揭示了IPF患者和小鼠模型中纤维化区域的特征。
人类IPF肺组织样本来自于接受肺移植手术的患者,而健康肺组织样本则来自无已知肺部疾病的捐赠者。每位IPF患者提供了三块不同程度纤维化的组织样本(分别表示轻度、中度和重度纤维化区域)。这些组织样本经过新鲜冷冻处理,并使用Visium空间基因表达平台进行分析。为了保证数据的准确性和完整性,每个样本产生了255-444百万条测序读数,平均每个样本约349百万条测序读数。
研究中每个样本分析的组织切片平均有约4000个捕获点(capture spots),每个捕获点代表组织中一群细胞的转录组,平均每个捕获点检测到超过1500个独特基因。
小鼠实验使用了8周龄的C57BL/6NCrl雌性小鼠,这些小鼠经过5天的适应期后,通过口咽途径给予博莱霉素或生理盐水。实验在给予博莱霉素后第7天和第21天分别收集肺组织样本,并进行后续的空间转录组学和RNA测序分析。每个小鼠样本产生了151-571百万条测序读数,平均每个样本约325百万条测序读数。
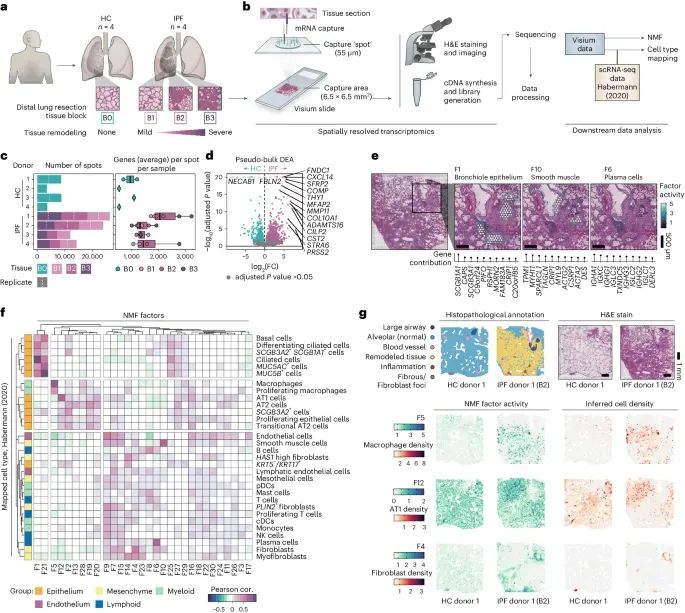
人肺纤维化的空间转录组学分析(Credit: Nature Genetics)
研究设计和样本选择:来自健康对照组(HCs)和特发性肺纤维化患者(IPF)的肺组织样本切片,使用Visium空间基因表达技术进行分析。每个IPF供体选择了三个反映纤维化损伤程度不同的组织块(B1, B2和B3)。
数据处理流程:Visium工作流程和后续数据处理步骤。使用非负矩阵分解(NMF)方法进行降维,生成了30个不同的因子。通过整合Habermann等人发表的单细胞RNA测序(scRNA-seq)数据,推断细胞类型分布。
数据概述:总结了每个样本的Visium捕获点数量和每个点检测到的独特基因数量。箱线图显示了数据的中位数、四分位数范围和离群值。
差异表达分析:健康对照组和IPF组之间的伪样本差异表达分析(DEA)结果,识别出了在条件之间显著差异表达的基因。
空间分布图:选定NMF因子的空间分布,这些因子对应于支气管上皮(F1)、平滑肌(F10)和浆细胞(F6)的组织学和/或转录特征。
因子活动与细胞类型密度相关性:NMF因子活动与推断细胞类型密度之间的皮尔逊相关性热图,使用Habermann等人的scRNA-seq数据进行分析,展示了所有样本中所有点的相关性。
病理学注释:提供了每个健康对照组和IPF组织块的组织切片的病理学注释基于H&E染色的Visium切片。通过可视化空间NMF活动和推断的细胞类型密度,展示了高度相关的因子-细胞对的共定位。
通过空间转录组学分析,研究团队生成了IPF患者和小鼠肺纤维化模型的基因表达图谱。这些图谱揭示了IPF肺中的不同纤维化生态位,并详细描述了这些生态位中细胞类型和信号通路的特征。
在IPF患者的肺组织样本中,研究人员发现了显著的基因表达差异。伪批量差异表达分析(Pseudobulk Differential Expression Analysis,DEA)鉴定出了1469个在IPF和健康对照之间差异显著的基因,这些基因与成纤维细胞相关,并且在先前研究中已被报道在IPF中上调,包括FNDC1、COL10A1和THY1等基因。
这些差异主要集中在纤维化区域(Fibroblastic Foci,FF)周围,且KRT5−/KRT17+异常基底样(Aberrant Basaloid,AbBa)上皮细胞密度较高。这些细胞群体与纤维化活动高度相关,表明其在IPF进展中可能扮演重要角色。在一些样本中,还观察到了基质金属蛋白酶(Matrix Metalloproteinases)和参与IPF相关信号通路的基因(如SFRP2、WNT10A和TGFBI)的上调。
在博莱霉素诱导的小鼠模型中,研究发现急性纤维化阶段(第7天)和慢性纤维化阶段(第21天)有显著的基因表达变化。第7天的样本显示出活跃的组织修复和炎症反应,而第21天的样本则显示出持续的纤维化和基质重塑。差异表达分析鉴定出第7天有3214个差异基因,第21天有3787个差异基因。
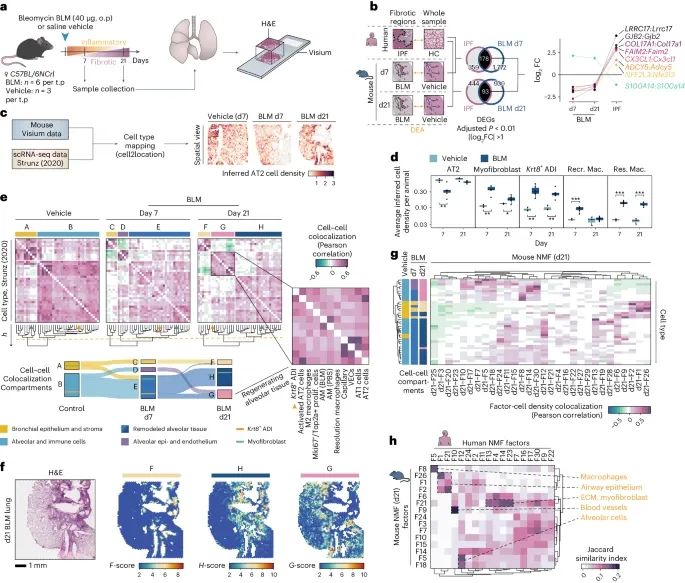
小鼠和人类肺纤维化的比较空间分析(Credit: Nature Genetics)
研究设计和样本选择:小鼠博来霉素(BLM)诱导肺纤维化模型的研究设计,包括在第7天(d7)和第21天(d21)分别收集博来霉素和生理盐水处理的小鼠肺样本。选择这些时间点是为了涵盖急性炎症和早期纤维化阶段(d7),以及已建立的纤维化阶段(d21)。
数据生成和分析:健康对照组和纤维化区域的差异表达基因(DEGs)分析结果,比较了小鼠模型和人类IPF样本中的DEGs。结果显示,有多达178个基因在小鼠和人类IPF纤维化区域之间重叠,但其中有八个基因在表达方向上表现出相反的变化,提示这些基因在两种模型中的功能可能不同。
细胞类型解卷积和空间可视化:通过单细胞RNA测序数据对小鼠肺纤维化样本进行细胞类型解卷积和空间可视化的结果。显示了在健康肺泡组织中推断的细胞类型分布,主要包括肺泡上皮细胞。
细胞类型密度变化:BLM处理和生理盐水对照组之间细胞类型密度的显著差异,包括解析(M2极化)巨噬细胞和Krt8+肺泡分化中间细胞(ADI细胞)。第7天时AT2细胞数量减少,但到第21天显示出恢复的趋势。第7天时促炎巨噬细胞的涌入在第21天时恢复正常,确认了急性炎症的解决。
动态肺组织重塑:小鼠肺组织在BLM损伤后进行的动态空间细胞类型分区分析。在生理盐水对照组肺中,鉴定了由支气管上皮(A)和肺泡(B)组织组成的两个区,标志着未受损的肺结构。在第7天BLM处理的小鼠肺中,识别出由支气管上皮(C)、肺泡上皮和肺泡毛细血管内皮(D)、以及由成纤维细胞和肌成纤维细胞标记的重塑肺泡组织(E)组成的突出细胞密度区域。到第21天,这些区的细胞组成发生了变化,除了支气管上皮(F)和纤维化重塑的肺泡组织(G)外,还包括充满炎症细胞和结构重塑的区域。
纤维化小鼠肺中细胞类型的动态变化:小鼠肺组织中不同时间点(d7和d21)的细胞类型的动态变化。主要展示了肺泡上皮细胞、成纤维细胞、巨噬细胞和肌成纤维细胞的分布和数量变化。结果显示,在d7时,小鼠肺组织中成纤维细胞和促炎巨噬细胞显著增加,表明急性炎症反应。在d21时,成纤维细胞和巨噬细胞的数量有所减少,但仍高于对照组,表明纤维化进程仍在进行。
空间转录组学揭示的基因表达变化:小鼠肺纤维化过程中不同时间点的特定基因表达变化。主要展示了与细胞外基质(ECM)重塑、炎症和纤维化相关的基因表达水平。结果显示,在d7时,MMP12、POSTN和COL1A1等基因的表达显著增加,这些基因与ECM重塑和纤维化密切相关。到d21时,这些基因的表达水平有所下降,但仍高于对照组,表明纤维化过程中的基因表达动态变化。
人IPF和小鼠模型之间的比较分析:人IPF样本和小鼠BLM模型之间在特定基因表达和细胞类型分布上的比较分析。主要展示了两者在基因表达模式和细胞类型上的相似性和差异。结果显示,一些关键基因如COL1A1和FN1在IPF和小鼠纤维化区域中都显著上调,表明这些基因在纤维化过程中的重要作用。同时,一些基因在两者之间的表达模式有所不同,提示人类IPF和小鼠模型在纤维化机制上存在一定的差异。
研究还通过单细胞RNA测序数据,揭示了与IPF相关的细胞状态,包括异常的上皮细胞、成纤维细胞和促纤维化肺泡巨噬细胞。还鉴定出一种新的KRT5−/KRT17+异常基底样上皮细胞群体,这些细胞表达上皮、基底和间充质标志物以及与衰老和细胞外基质(Extracellular Matrix,ECM)产生相关的基因。尽管这些细胞可能源自肺泡II型细胞(Alveolar Type 2,AT2)或Clara细胞,但它们在纤维化微环境中的角色仍不清楚。
在研究中发现,IPF肺纤维化生态位中,转化生长因子β(Transforming Growth Factor Beta,TGF-β)信号通路占主导地位,并伴有TP53和APOE等预测调控因子。同时,还观察到肺泡上皮细胞的再生受阻,与急性纤维化小鼠模型中的活跃组织修复形成鲜明对比。
该研究通过空间转录组学和单细胞RNA测序技术,详细描绘了IPF和小鼠肺纤维化模型中的细胞相互作用和信号传导途径,揭示了关键的趋同和分歧路径。这些发现为我们提供了对IPF细胞相互作用的深入理解,并提出了肺泡再生作为IPF潜在治疗策略的前景。未来的研究可进一步探讨KRT5−/KRT17+异常基底样上皮细胞在IPF中的具体功能及其调控机制。此外,研究还可关注不同纤维化阶段的细胞相互作用和信号传导变化,以期为IPF的治疗提供新的靶点和策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


